免疫组化结果如何分析?手动计数经常2遍结果不一致?经常数到头昏眼花?这一篇Image J分析免疫组化结果的教程它来啦!从软件安装到操作步骤的干货全教给你,新手也能 10 分钟上手。
使用FIJI分析免疫组化结果通常有两种,一种是直接分析,一种是用插件分析,本期咱们讲第一种。
1.打开图像
通过File → Open打开图像或把图像拖到软件上
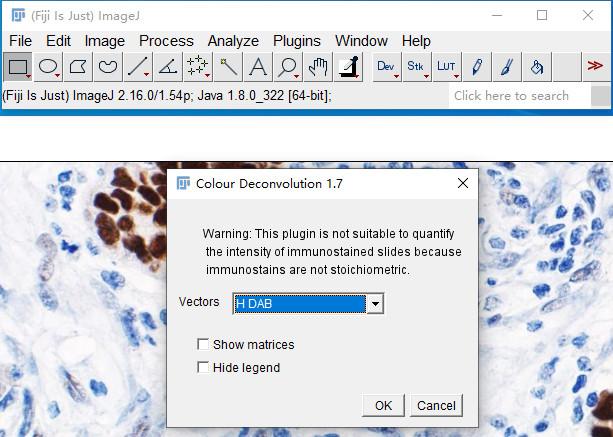
2.图像去卷积
Why:可以提高图像质量,从而获得更可靠、更详细的信息,便于后续分析和展示
How:选择Image → Color → Color Deconvolution-H DAB。(保留colour_2,其他关掉)
注意:Fiji集成了 Color Deconvolution,Image J则需要另外安装,需要安装方法的可评论区留言。
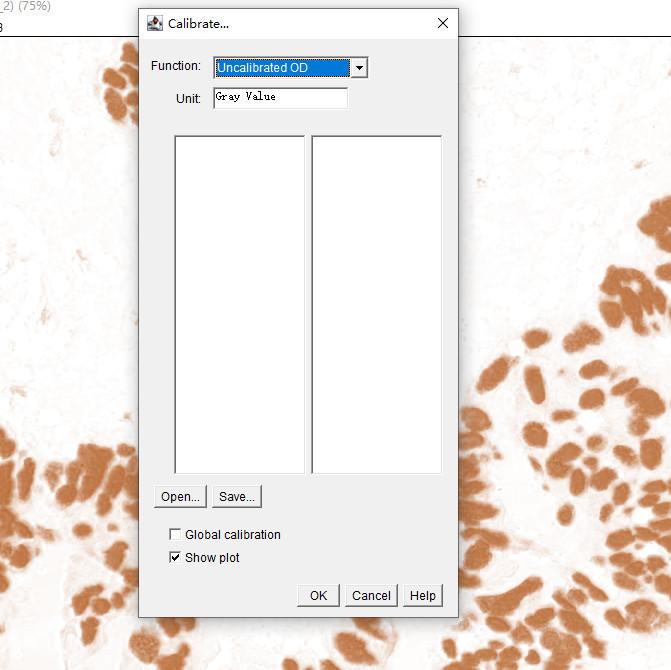
3.灰度值转换光密度值
灰度值
定义: 数字图像中单个像素的亮度或强度值。它表示该像素位置接收到的光信号的相对强度(对于相机或扫描仪等探测器而言)。

在8-bit 图像: 0 (纯黑) 到 255 (纯白),0 代表探测器在该位置检测到的光信号最弱(或无信号,即最暗/黑)。最大值(如 255)代表探测器在该位置检测到的光信号最强(或饱和,即最亮/白)。

OD值(光密度值)
定义: 表示透射过样品某一点的光被吸收的程度。它是一个物理量,描述样品本身对光的衰减能力。
OD值的范围从连续实数 (0 到 +∞),0值表示无吸收/完全透明 ,最大值表示无限吸收/完全不透明。
免疫组化为什么要转换下呢?
如果用灰度来统计,纯白背景的数值为255,DAB着色越深,数值反而越小,这个和我们的认知相反。如果以光密度值来分析,背景纯白的值接近于0,DAB着色越深,OD值越大,这样更符合实际情况。
How:Analyze→Calibrate→拉到底部Uncalibrated OD→OK
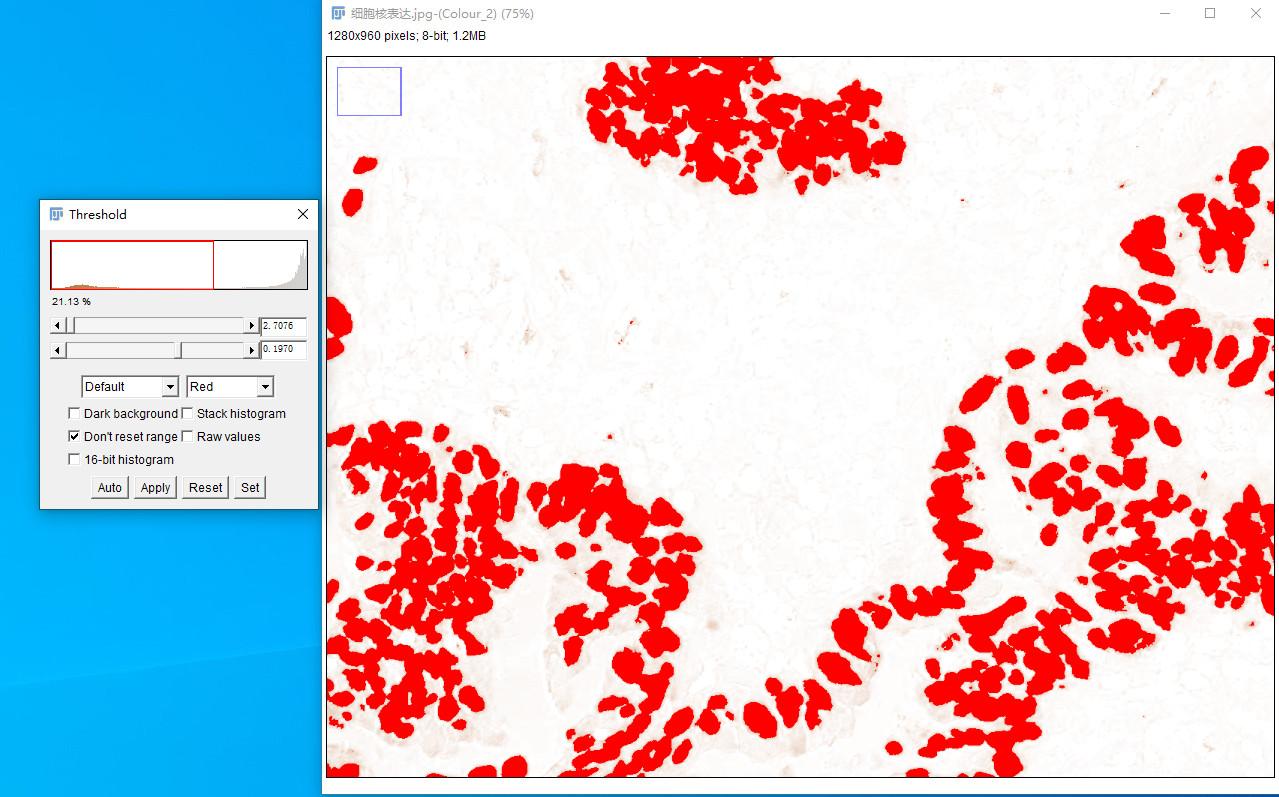
4.调整阈值
Why:手动调整使阳性染色区域更贴近实际情况
How::Image → Adjust → Threshold,左右拉动进度条调整到满意为止
5.设置测量参数
Why:告诉软件测量哪些参数
How::Analyze → Set Measurements,选择需要测量的参数
6.测量结果
How:Analyze → Measure
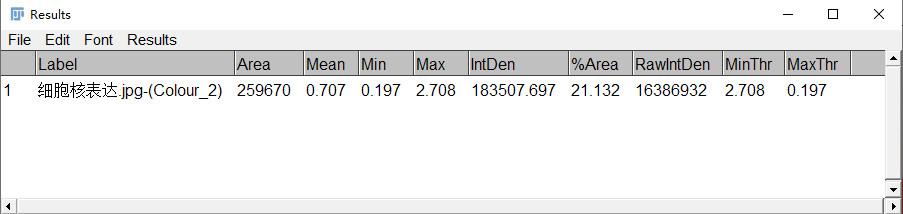
7.结果解读
Area:区域覆盖的面积
Mean:区域平均OD值
Min:区域最小OD值
Max:区域最大OD值
RawIntDen:区域总灰度值
IntDen(Integratedoption density,IOD):累积光密度值,即阳性区域内所有像素的光密度值之和
%Area:阳性面积百分比,(选中区域内的阳性面积 ÷ 选中区域的总面积)× 100%
AOD(AverageOptical Density):平均光密度值,是累积光密度值(IOD)与阳性区域面积的比值,公式:平均光密度值 = IOD / 阳性区域面积
AOD和%Area区别
%Area计算 “面积占比”,它只关注 “阳性区域占了多少地方”,不关心这些区域的染色是深是浅 —— 哪怕阳性区染色很淡(接近背景色),只要被判定为 “阳性”,就会被计入面积。它反映的是阳性信号的“分布范围”——比如,模型组中BDNF的阳性染色面积比正常组大4倍,说明阳性信号的扩散范围更广。
AOD计算 “光信号强度”,因此,平均光密度值反映的是阳性信号的“平均强度”——比如,模型组中BDNF的阳性区域平均光密度值比正常组高1倍,说明每个阳性像素的染色更深,蛋白表达量可能更高。
生物学意义:一个说 “有多少细胞阳性”,一个说 “阳性细胞表达有多强”。
如果你关注的是“阳性信号覆盖了多少区域”(比如,炎症细胞的浸润范围、血管的新生范围),选**%Area**;
如果你关注的是“阳性信号的强弱”(比如,蛋白的表达量、受体的密度),选平均光密度值。
正确解读案例
某研究用免疫组化检测大脑中动脉阻塞(MCAO)模型大鼠脑皮质中BDNF的表达,结果如下:
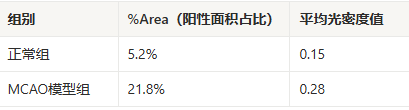
解读:
%Area升高(5.2%→21.8%):说明模型组中BDNF的阳性染色面积比正常组大,即阳性信号的“分布范围”更广(比如,原本只有少量神经元表达BDNF,现在更多神经元甚至胶质细胞都表达了)。
平均光密度值升高(0.15→0.28):说明模型组中每个阳性像素的染色更深,即阳性信号的“强度”更高(比如,原本每个表达BDNF的神经元染色较浅,现在染色更深)。
错误解读案例
有同学研究 “药物对某蛋白的调控作用”,只测了 % Area—— 发现用药组和对照组的 % Area 都是 30%,就得出 “药物无作用” 的结论。但其实若测了 AOD,可能发现用药组的 AOD 从 2.5 降到 1.2(染色变浅),说明药物虽然没减少阳性细胞数量,却降低了蛋白表达强度,结论完全不同。
总结
研究阳性信号的“分布范围”选%Area,比如:炎症细胞浸润范围、血管新生范围、阳性细胞数量比率(如Ki67、CD3)。
研究阳性信号的“平均强度”,比如:蛋白表达量(如BDNF、VEGF)、受体密度、染色深浅;
在实际研究中,%Area与平均光密度值结合使用,才能全面反映免疫组化结果的“量”(分布范围)与“质”(信号强度)。很多期刊也要求 “完整呈现免疫组化分析数据”,单独给 % Area 或 AOD 可能被审稿人质疑 “数据不完整”,两者结合能让结论更可信。
实验外包 想了解更多请关注:http://www.do-gene.cn

